- Jak nemoc fenylketonurie
- Mechanismus rozvoje nemocí
- Fenylketonurie u dětí
- Příznaky onemocnění
- Příčiny a provokující faktory
- Diagnostika
- Léčba klasické fenylketonurie
- Zvláštnosti výživy novorozenců a dietní terapie
- Strava pro předškolní děti a žáky
- Skupiny produktů pro PKU
- Jak kontrolovat hladiny fenylalaninu v krvi
- Video
Pomozte vývoji webu a sdílení článku s přáteli!
Nemoc, jejíž výskyt je spojen s poruchami genetického buněčného aparátu, fenylketonurie, je zahrnuta v několika seznamech dědičných onemocnění léčitelných. Průkopníkem této choroby byl lékař z Norska I.A. Kácení, později bylo zjištěno, že za vývoj a průběh onemocnění je zodpovědný jediný gen, nazývaný gen fenylalaninhydroxylázy (dlouhé rameno 12. chromozomu, obsahující až 4, 5% materiálu celkové buněčné DNA). Vrozená vada vede k částečné nebo úplné deaktivaci jaterního enzymu fenylalanin-4-hydroxylázy.
Jak nemoc fenylketonurie
Dědičné onemocnění fenylketonurie (PKU) vede k chronické otravě těla toxickými látkami vznikajícími v důsledku zhoršeného metabolismu aminokyselin a procesu hydroxylace fenylalaninu. Konstantní intoxikace způsobuje poškození centrálního nervového systému (CNS), jehož projevem je progresivní pokles inteligence (fenylpyruvová oligofrenie).
Kácení onemocnění se projevuje nadměrnou akumulací fenylalaninu v těle a jeho nesprávným metabolismem. Mezi další faktory ve vývoji fenylketonurie patří zhoršený transport aminokyselin přes hematoencefalickou bariéru, nízké hladiny neurotransmiterů (serotonin, histamin, dopamin). Při absenci včasné léčby vede onemocnění k mentální retardaci a může způsobit smrt dítěte.

Mechanismus rozvoje nemocí
Kauzálním faktorem výskytu genových poruch je metabolický blok, který zabraňuje tvorbě fenylalanin-4-hydroxylázy (enzymu zodpovědného za přeměnu aminokyseliny fenylalaninu na tyrosin). Proteinogenní aminokyselina tyrosin je složkou proteinů a melaninového pigmentu, proto je nezbytným prvkem pro fungování všech tělesných systémů a jeho nedostatek vede k fermentopatie.
Důsledkem potlačení tvorby metabolitu způsobeného mutační inaktivací enzymu je aktivace pomocných cest metabolismu fenylalaninu. Aromatická alfa-aminokyselina v důsledku defektních metabolických procesů se rozpadá na toxické deriváty, které se za normálních podmínek netvoří:
- Kyselina fenylpyrohroznová (fenylpyruvát) je mastná aromatická alfa-keto kyselina, její tvorba vede k myelinaci neuronálních procesů a demence;
- Kyselina fenyl-mléčná - produkt vznikající při redukci kyseliny fenylpyrohroznové;
- Fenylethylamin - výchozí sloučenina pro biologicky aktivní vysílače elektrochemických pulzů, zvyšuje koncentraci dopaminu, adrenalinu a noradrenalinu;
- ortofenylacetát je toxická látka, která způsobuje poruchu metabolických procesů sloučenin podobných tuku v mozku.
Lékařské statistiky naznačují, že patologicky změněný gen je přítomen ve 2% populace, ale neprojevuje se. Genetický defekt se přenáší na dítě od rodičů pouze tehdy, je-li onemocnění přítomno u obou partnerů a v 50% případů se dítě stává nositelem mutovaného genu, který zůstává zdravý. Pravděpodobnost, že fenylketonurie u novorozenců povede k onemocnění, je 25%.
Jaký typ je zděděn
Kácení onemocnění je genetická porucha dědičná autosomálně recesivním způsobem. Tento typ dědičnosti znamená, že k rozvoji příznaků vrozené choroby dojde pouze tehdy, když dítě zdědí jednu vadnou genokopii od obou rodičů, kteří jsou heterozygotními nosiči modifikovaného genu.
Vývoj vrozené choroby v 99% případů způsobuje mutaci genu zodpovědného za kódování enzymu, který zajišťuje syntézu fenylalanin-4-hydroxylázy (klasické fenylketonurie). Až 1% genetických onemocnění je spojeno s mutačními změnami, které se vyskytují v jiných genech a způsobují deficienci dihydropteridin reduktázy (PKU typu II) nebo tetrahydrobiopterinu (PKU typu III).
Fenylketonurie u dětí
Klasická forma genetického onemocnění u dětí se ve většině případů projevuje externě rozpoznatelnými znaky od 3-9 měsíců života. Novorozenci s vadným genem vypadají zdravě, výrazným rysem je specifický habitus (vzhled) dítěte. Závažné příznaky se objevují 6-12 měsíců po porodu.
PKU typ II se vyznačuje tím, že první klinické symptomy se objevují po 1, 5 roce od okamžiku narození. Symptomy nemoci nezmizí po diagnóze genetických abnormalit a zahájení dietní terapie. Tento typ vrozené nemoci často vede k smrti v 2-3 letech života dítěte. Nejčastějšími příznaky PKU typu II jsou:
- výrazné odchylky v duševním vývoji;
- hyperreflexie;
- porušení motorických funkcí všech končetin;
- syndrom nekontrolovaných svalových kontrakcí.
- vysoký stupeň mentální retardace;
- jasně snížená velikost lebky vzhledem k ostatním částem těla;
- svalová spasticita (s možnou úplnou nehybností končetin).

Projevy choroby kácení
V průběhu klinických studií a pozorování bylo navrženo, že účinky toxických derivátů metabolismu fenylalaninu způsobují pokles intelektuálních schopností, které jsou progresivní a mohou vést k demenci (oligofrenie, idiocy). Mezi údajnými příčinami nevratných poruch aktivity mozku je nejvhodnější nedostatek neurotransmiterů přenášejících impulsy mezi neurony způsobené snížením hladiny tyrosinu.
Přesný kauzální vztah mezi dědičným onemocněním a poruchami mozku nebyl dosud identifikován, ani vývojový mechanismus v důsledku fenylketonurie takových duševních stavů, jako je ekopraxie, echolalia, záchvaty hněvu a podrážděnosti. Data z výsledků testů ukazují, že fenylalanin má přímý toxický účinek na mozek, což může také způsobit snížení inteligence.
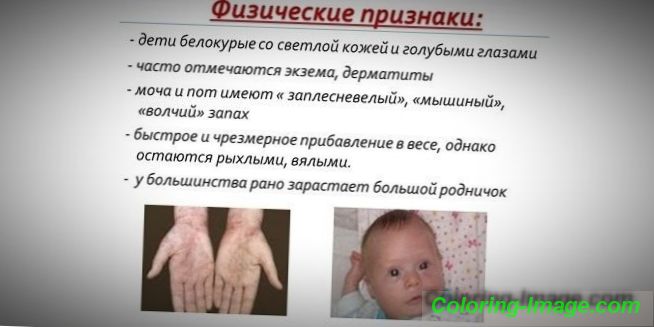
Fyzikální a fenotypové rysy
Vzhledem k tomu, že pigment kůže a vlasů závisí na hladině tyrosinu v mitochondriích hepatocytů a fenylketonurie zastavuje konverzi fenylalaninu, pacienti s tímto onemocněním mají fenotypové znaky (recesivní symptomy). Zvýšený svalový tonus způsobuje odchylku v těle - stává se dysplastickou. Výrazné vnější znaky fenylketonurie zahrnují:
- hypopigmentace - lehká kůže, světle modré oči, bělené vlasy;
- modřiny končetin;
- snížená velikost hlavy;
- specifické postavení těla - když se snažíte stát nebo sedět, dítě zaujímá postoj „krejčího“ (paže a nohy ohnuté v kloubech).
Příznaky onemocnění
S včasnou detekcí je Fellingova choroba přístupná úspěšné léčbě úpravou výživy a vývoj dítěte probíhá v souladu s věkovou skupinou. Obtížnost při detekci genové mutace spočívá v tom, že je obtížné odhalit časné příznaky i pro zkušeného pediatra. Závažnost symptomů vrozené nemoci se zvyšuje s růstem dítěte, protože užívání proteinových potravin přispívá k rozvoji poruch CNS.
Známky u novorozenců
Během prvních dnů života dítěte je obtížné odhalit známky patologických abnormalit - dítě se chová přirozeně a nedochází k žádnému zpoždění vývoje. Symptomy onemocnění se poprvé objevují v 2-6 měsících po narození. Rodiče by měli být upozorněni na chování dítěte, které je charakterizováno nízkou aktivitou, letargií nebo naopak úzkostí, hypercitlivostí.
Se začátkem kojení začnou bílkoviny do těla novorozence proudit mlékem, které slouží jako katalyzátor vzniku prvních příznaků, které jasně naznačují, že nemoc začala postupovat. Mezi specifické klinické projevy onemocnění patří:
- přetrvávající zvracení (často mylné pro vrozené zúžení pyloru);
- častá regurgitace;
- nedostatek reakce na vnější podněty;
- svalová dystonie (snížené svalové napětí);
- křečovitý syndrom (záchvaty epileptické nebo neepileptické povahy).
Příznaky u dětí po 6 měsících
Pokud se projev genetického onemocnění nevyskytl (nebo nebyl zaznamenán) během prvních 6 měsíců od okamžiku narození dítěte, je možné po této době již přesně určit psychomotorické zpoždění. Symptomy genetických poruch způsobených nedostatkem enzymů u dětí starších než šest měsíců jsou:
- snížení aktivity (až do úplné lhostejnosti);
- žádné pokusy postavit se na vlastní pěst, sedící;
- speciální „myší“ vůně na kůži (zápach plísně vzniká v důsledku vylučování toxických derivátů fenylalaninu přes potní žlázy a moč);
- ztráta schopnosti vizuálního rozpoznání rodičů;
- odlupování kůže;
- výskyt dermatitidy, ekzémů, sklerodermie.
Progresi onemocnění v nepřítomnosti léčby v dětství
Pokud vývojové abnormality nebyly zjištěny v kojeneckém věku a nebyla provedena vhodná léčba, pak se nemoc začíná aktivně rozvíjet a často vede k invaliditě. Nedostatek léčby v raném stádiu onemocnění způsobuje výskyt následujících příznaků onemocnění již ve věku 1, 5 roku:
- mikrocefalie (snížená velikost mozku);
- prognathia (posunutí horní chrupu dopředu);
- pozdní kousání;
- hypoplazie skloviny (řídnutí nebo úplná absence zubní skloviny);
- zpožděný vývoj řeči až do úplného nedostatku řeči;
- 3, 4 stupeň oligofrenie (mentální retardace, mentální retardace);
- vrozené srdeční vady (defekty ve struktuře srdečního svalu, části srdce, velké cévy);
- poruchy vegetativního systému (acrocyanóza, nadměrné pocení, arteriální hypotenze);
- zácpa.
Příčiny a provokující faktory
U mutací s autosomálně recesivním vzorem dědičnosti musí být defektní gen zděděn od obou rodičů. Genetická onemocnění tohoto typu se vyskytují se stejnou četností u novorozených chlapců a dívek. Patogeneze PKU je dána metabolickou poruchou fenylalaninu, která se může vyskytovat ve 3 formách. Pouze klasickou fenylketonurií typu I lze léčit dietní terapií.
Atypické formy nemoci nelze vyléčit úpravou diety. Tyto odchylky jsou způsobeny nedostatkem tetrahydropterinu, dehydropterin reduktázy (méně často pyruvoyl tetrahydropterin syntáza, guanosin-5-trifosfát cyklohydrolase, atd.). Většina případů letálních výsledků byla zaznamenána u pacientů se vzácnými variacemi PKU, zatímco klinické projevy všech forem onemocnění jsou podobné. Riziko výskytu dítěte s mutovaným genem fenylalaninhydroxylázy se zvyšuje, pokud jsou jeho rodiče blízcí příbuzní (v těsně příbuzných manželstvích).
Diagnostika
Je-li podezření na genetickou poruchu, stanoví se diagnóza na základě kombinace údajů získaných studiem historie onemocnění - genealogických informací, výsledků klinického a lékařského genetického výzkumu. Pro včasné odhalení vrozených onemocnění (PKU, cystická fibróza, galaktosémie atd.) Byl pro všechny novorozence (novorozenecký screening) vyvinut program povinného screeningu.
Pokud budoucí rodiče vědí o přepravě mutovaného genu, moderní medicína nabízí způsoby, jak odhalit defekt během těhotenství (prenatální diagnostika plodu invazivní metodou). Pro separaci fenylketonurie na druhy podle závažnosti se používá podmíněná klasifikace, která je založena na hladině fenylalaninu v tekutině bez fibrinu získané z krevní plazmy:
- Těžká fenylketonurie - 1200 µmol / l.
- Průměr je 60-1200 μmol / l.
- Světlo (nevyžaduje léčbu) - 480 µmol / l.
Screening test
Identifikace genetických abnormalit probíhá v několika fázích. V první fázi porodnice, pro všechny děti ve věku 3-5 dnů, se odebírá periferní krev (z paty) pro výzkum. Materiál je aplikován na papír a zaslán do biochemické laboratoře, kde je biochemická analýza. Ve druhé fázi screeningového testu se stanoví, že koncentrace fenylalaninu je normální.
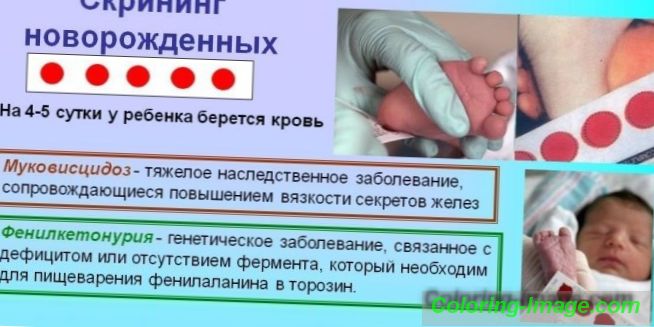
Pokud nejsou zjištěny žádné patologické změny, je diagnóza dokončena a na kartě dítěte je proveden záznam. V případě odchylky od normy jsou výsledky diagnózy zasílány pediatrovi, aby poskytly objasňující vyšetření vzorku krve novorozence. Zdraví dítěte závisí na včasném a přesném provedení všech opatření k identifikaci odchylek. Pokud je diagnóza potvrzena po opětovném screeningu, budou rodiče dítěte předáni na kliniku pro pediatrickou genetiku pro léčebné účely.
Analýzy a studie k potvrzení diagnózy
Opakovaná diagnostika, pokud jsou během počátečního screeningového testu zjištěny abnormality, se provádí opakovanými testy. Metody diagnostiky PKU u dětí a dospělých zahrnují kromě stanovení obsahu fenylalaninu v krvi: \ t
- Test kácení - stanovení kyseliny fenylpyrohroznové v moči přidáním chloridu železitého do biomateriálu (dochází k modrozelenému zabarvení);
- Guthrieho test - hodnocení stupně reakce mikroorganismů na metabolické produkty nebo enzymy obsažené v krvi pacienta;
- chromatografie - studium chemických vlastností látek distribuovaných mezi dvěma fázemi;
- fluorimetrie - záření biomateriálu monochromatickým zářením pro stanovení koncentrace látek v něm obsažených;
- elektroencefalografie - diagnostika elektrické aktivity mozku;
- Zobrazování magnetickou rezonancí je excitací atomových jader buněk elektromagnetickými vlnami a měřením jejich odezvy.
Léčba klasické fenylketonurie
Základem terapie fenylketonurií je omezení spotřeby produktů, které jsou zdrojem živočišných a rostlinných proteinů. Jedinou metodou úspěšné léčby je dietní terapie, jejíž adekvátnost je hodnocena obsahem fenylalaninu v krevním séru. Maximální přípustná hladina aminokyselin u pacientů různých věkových skupin je:
- u novorozenců a dětí do 3 let - do 242 µmol / l;
- u dětí předškolního věku - do 360 µmol / l;
- u pacientů ve věku od 7 do 14 let - do 480 µmol / l;
- u dospívajících až do 600 μmol / l.
Účinnost stravy závisí na stadiu, ve kterém bylo onemocnění upraveno. S časnou diagnózou vrozené patologie je dietní léčba předepsána od 8. týdne života (po tomto období začínají nevratné změny). Nedostatek včasných opatření vede ke komplikacím a snížení úrovně inteligence o 4 body po dobu 1 měsíce od okamžiku narození do zahájení léčby.

Vzhledem k tomu, že terapeutická strava pro fenylketonurii předpokládá úplnou eliminaci živočišných bílkovin z potravy, je nutné použít jiné zdroje esenciálních aminokyselin, jakož i vitamíny skupiny B, minerální sloučeniny obsahující vápník a fosfor. Produkty označené jako doplňky stravy bez obsahu bílkovin zahrnují: \ t
- proteinové hydrolyzáty (Amigen, Aminazol, Fibrinosol);
- směs bez fenylalaninu nasycená esenciálními aminokyselinami - tetrafenem, bez fenylu.
Spolu s nápravnými opatřeními k odstranění příčiny zhoršené funkce těla by měla být provedena symptomatická léčba zaměřená na odstranění poruch řeči a normalizaci koordinace pohybů. Kombinovaná terapie zahrnuje fyzioterapeutické procedury, masáže, pomoc logopeda, psychologa, gymnastické cvičení. V některých případech je spolu s dietní terapií indikováno použití antikonvulziv, nootropních a vaskulárních léků.
Vlastnosti léčby atypických forem
Fenylketonurie typu II a typu III nelze léčit dietou s nízkým obsahem bílkovin - hladina fenylalaninu v krvi zůstává nezměněna, pokud je příjem bílkovin v těle omezen nebo se klinické symptomy vyvíjejí i při poklesu hladiny aminokyselin. Účinná terapie těchto forem onemocnění se provádí pomocí:
- tetrahydrobiopterin - faktor postiženého enzymu;
- syntetické analogy tetrahydrobiopterinu - tyto látky pronikají lépe hematoencefalickou bariérou;
- substituční léčiva - nevylučují příčinu fenylketonurie, ale podporují normální fungování těla (Levodopa spolu s karbidofou, 5-hydroxytryptofanem, 5-formyl tetrahydrofolátem);
- hepatoprotektory - podporují fungování jater;
- antikonvulziva;
- zavedení genu fenylalanin hydroxylázy v játrech - experimentální metoda.
Zvláštnosti výživy novorozenců a dietní terapie
V prvním roce života dítěte s PKU je kojení přijatelné, ale jeho množství by mělo být omezeno. Přípustná hladina příjmu fenylalaninu do 6 měsíců je 60-90 mg na 1 kg hmotnosti dítěte (100 g mléka obsahuje 5, 6 mg fenylalaninu). Od 3 měsíců by měla být dieta dítěte postupně rozšířena o ovocné šťávy a bramborovou kaší.
Děti od 6 měsíců umožnily zavést do stravy zeleninové pyré, ovesnou kaši (z sága), bezproteinové polibky. Po 7 měsících můžete dát své dítě s nízkým obsahem bílkovin těstoviny, od 8 měsíců - chléb, který neobsahuje bílkoviny. Věk, do kterého je nutné omezit příjem bílkovin v těle nemocného dítěte, nebyl stanoven. Lékaři doposud diskutují o proveditelnosti celoživotní dietní terapie, ale souhlasí s tím, že je nutné dodržovat dietní dietu po dobu nejméně 18 let.
Fenylketonurie, diagnostikovaná u ženy, není důvodem k odmítnutí porodit dítě. Nastávající matky s PKU k prevenci poškození plodu během těhotenství a prevence možných komplikací jsou nezbytné před plánovaným pojetím a při přepravě dítěte s následnou dietou s omezením fenylalaninu (jeho hladina v krvi by měla být až 242 µmol / l).
Přípravek bez laktózy pro kojence
Strava s fenylketonurií je založena na významném snížení dávky přírodního proteinu v denní stravě, ale tělo novorozence se nemůže vyvíjet normálně v nepřítomnosti nezbytných mikroživin. Pro uspokojení potřeb dítěte v proteinu se používají směsi aminokyselin neobsahující laktózu, které by podle ruské legislativy měly být pacientům poskytovány zdarma.
Tolerance kojenců k fenylalaninu během prvního roku života se rychle mění, proto je nutné sledovat jeho koncentraci v dětské krvi a provádět úpravy stravy. Směsi jsou určeny pro specifické věkové skupiny:
- děti do jednoho roku jsou jmenovány Afenilak 15, Analog-SP, PKU-1, PKU-mix, PKU Anamix;
- děti starší než 1 rok mají předepsané směsi obohacené vitamíny a minerály s vysokým obsahem bílkovin - PKU Prima, P-AM Universal, PKU-1, PKU-2, XP Maxameyd, XP Maxamum.

Dietní výrobky pro doplnění zásob bílkovin
Jednou z hlavních složek potravinové stravy s fenylketonurií jsou potraviny s nízkým obsahem bílkovin na bázi škrobu. Tyto doplňky obsahují kasein hydrolyzát, tryptofan, tyrosin, methionin, dusík a poskytují dětem denní potřebu bílkovin, což je nezbytné pro normální vývoj a růst. Specializované produkty, které kompenzují nedostatek esenciálních minerálů a aminokyselin, když nemají dostatek potravy, jsou:
- Berlofen;
- Tsimorgan;
- Minafen;
- Aponti.
Strava pro předškolní děti a žáky
Vzhledem k tomu, že se tělo přizpůsobuje fenylalaninu, mohou děti od 5 let postupně snižovat dietní omezení. K rozšiřování stravy dochází prostřednictvím zavádění obilovin, mléčných výrobků, masných výrobků. Studenti středních škol již mají vysokou toleranci k fenylalaninu, takže v tomto věku můžete pokračovat v rozšiřování stravy, zatímco je nutné sledovat reakci na všechny změny ve stravě. Ke kontrole stavu dítěte se používají následující metody:
- hodnocení neurologických ukazatelů, psychologický stav;
- monitorování výkonu elektroencefalogramu;
- stanovení hladiny fenylalaninu.
Skupiny produktů pro PKU
Strava pacientů s PKU spolu s nízkotučnými škrobovými potravinami a terapeutickými směsmi zahrnuje také produkty přírodního původu. Při sestavování menu je třeba jasně vypočítat množství spotřebovaného proteinu a nepřesáhnout dávku doporučovanou lékařem. Aby se vyloučily toxické účinky na tělo, byly vyvinuty 3 seznamy produktů, které obsahují zakázané (červené), nedoporučené (oranžové) a povolené (zelené) pozice.
Červený seznam
Fenylketonurie se vyvíjí na pozadí nepřítomnosti enzymu, který přeměňuje fenylalanin na tyrosin, takže vysoký obsah bílkovin je důvodem pro přiřazení produktů do zakázaného (červeného) seznamu. Pozice z tohoto seznamu by měly zcela vyloučit dietu pacienta PKU:
- maso;
- vnitřní orgány zvířat, droby;
- klobásy, klobásy;
- mořské plody (včetně ryb);
- vejce všech ptáků;
- fermentované mléčné výrobky;
- ořechy;
- ovoce luštěnin a obilnin;
- sójové výrobky;
- nádobí obsahující želatinu;
- Cukrovinky;
- aspartam.
Oranžový seznam
Výrobky, které by měly být dávkovány do těla dítěte diagnostikovaného PKU, jsou zařazeny do oranžového seznamu. Zahrnutí pozic z tohoto seznamu do stravy je přijatelné, ale v přísně omezených množstvích. I když tyto produkty neobsahují mnoho bílkovin, mohu také zvýšit hladinu fenylalaninu, proto se jejich použití nedoporučuje:
- Konzervovaná zelenina;
- pokrmy z brambor a rýže;
- zelí;
- mléko;
- sherbet
Zelený seznam
Bezproteinové produkty jsou povoleny pro použití u pacientů s diagnózou fenylketonurie bez omezení. Před nákupem položek ze zeleného seznamu musíte zkontrolovat složení uvedené na obalu a ujistit se, že neobsahuje aspartamové barvivo obsahující fenylalanin:
- ovoce;
- zelenina (kromě brambor a zelí);
- bobule;
- zelené;
- škrobové obilniny (ságo);
- med, cukr, džem;
- výrobky z mouky z kukuřičné nebo rýžové mouky;
- oleje, tuky (krémová, zeleninová, olivová).
Jak kontrolovat hladiny fenylalaninu v krvi
Fenylketonurie je nevyléčitelná choroba, která může být převedena do fáze stagnace pomocí dietní terapie a terapeutických opatření. Se změnou životních podmínek, podvýživou se onemocnění může opět zhoršit, takže pacienti potřebují celoživotní pozorování. Proces monitorování spočívá v pravidelném stanovení hladiny fenylalaninu v krvi. Frekvence testování závisí na věku pacienta:
- až 3 měsíce - krevní screening by měl být prováděn jednou týdně, dokud nebudou získány stabilní výsledky;
- od 3 měsíců do 1 roku - 1-2 krát měsíčně;
- od 1 do 3 let - 1 krát za 2 měsíce;
- starší než 3 roky - čtvrtletně.

Krev na testy se provádí 3-4 hodiny po jídle. Kromě screeningu je vývoj PKU monitorován stanovením nutričního stavu, fyzického, emocionálního vývoje pacienta, úrovně intelektuálních schopností a vývoje jazyka. Podle výsledků pozorování může být nezbytné provést další diagnostiku za účasti příslušných odborníků.